อะตอมและตารางธาตุ
แบบจำลองอะตอม
ในสมัยโบราณมีนักปราชญ์ชาวกรีกชื่อ ดิโคริตุส ( Democritus ) เชื่อว่าเมื่อย่อยสารลงเรื่ออย ๆ จะได้ส่วนที่เล็กที่สุดซึ่งไม่สามารถทำให้เล็กลงกว่าเดิมได้อีก และเรียกอนุภาคขนาดเล็กที่สุดว่า อะตอม ซึ่งคำว่า "อะตอม"( atom ) เป็นคำซึ่งมาจากภาษากรีกว่า ( atomas ) แปลว่า แบ่งแยกอีกไม่ได้
1.แบบจำลองอะตอมของดอลตัน
สสารทั้งหลายประกอบด้วยอนุภาคที่เล็กที่สุด จะไม่สามารถมองเห็นได้และจะไม่สามารถแบ่งแยกให้เล็กลงกว่านั้นได้อีก แต่ในสมัยนั้นก็ยังไม่มีการทดลอง เพื่อพิสูจน์และสนับสนุนแนวความคิดดังกล่าว
แบบจำลองอะตอม ( Atomic model ) เนื่องจากอะตมมีขนาดเล็กมาก ซึ่งสายตามนุษย์ไม่อาจมองเห็นได้ด้วยตาเปล่า ในปัจจุบันนักวิทยาศาสตร์ได้พัฒนาเครื่องมือที่เรียกว่า atomic force microscope (AFM) ซึ่ใช้งานทางด้านวิทยาศาสตร์ระดับนาโนในการสร้างเป็นภาพลักษณ์พื้นผิวที่เป็นเชิงโครงสร้างระดับอะตอม โดยการผ่านแสงเลเซอร์ไปที่ส่วนปลายแหลมขนาดระดับอะตอมที่อยู่ใต้คาน และเมื่อคานลากส่วนปลายแหลมกวาดผ่านไปทั่วผิวที่เป็นโครงสร้างระดับอะตอมของวัตถุ เครื่องจะสามารถตรวจวัดความสูงต่ำของพื้นผิว การปรับตำแหน่งของคานจะทำให้ลำแสงเลเซอร์ที่จะสะท้อนจากคานเปลี่ยนตำแหน่งไปด้วย ซึ่งจะถูกนำมาแปรสัญญาณเพื่อสร้างเป็นภาพพื้นผิวที่มีลักษณะเชิงโครงระดับอะตอมแสดงบนจอภาพได้
2.แบบจำลองของทอมสัน
เดียวกันย่อมมีสมบัติเหมือนกัน มีมวลเท่าๆกัน แต่จะมีสมบัติแตกต่างกันจากอะตอมของธาตุอื่น
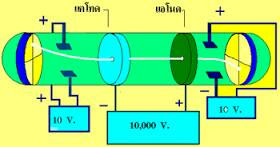
เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟเาชองก๊าซโดยใช้หลอดรังสีแคโทด
หลอดรังสีแคโทด
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ ( SirWilliam Crookes ) ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด
3.แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
การค้นพบอิเล็กตรอน
เซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่
รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะุลุออกไปกระทบกับฉากเรืองแสง
ปรากฎว่า รังสีนี้จะเบี่ยงเบนเข้าหาขั้วบวก แสดงว่า รังสีนี้ต้องเป็นประจุลบ แต่ไม่ทราบว่าเกิดจากก๊าซในหลอดรังสีแคโทด หรือเกิดจากขั้วไฟฟ้าทอมสันจึงทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่า ไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้ผลการทดลองเหมือนเดิม จึงสรุปได้ว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า "อิเล็กตรอน"
รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะุลุออกไปกระทบกับฉากเรืองแสง
หลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทด
ปรากฎว่า รังสีนี้จะเบี่ยงเบนเข้าหาขั้วบวก แสดงว่า รังสีนี้ต้องเป็นประจุลบ แต่ไม่ทราบว่าเกิดจากก๊าซในหลอดรังสีแคโทด หรือเกิดจากขั้วไฟฟ้าทอมสันจึงทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่า ไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้ผลการทดลองเหมือนเดิม จึงสรุปได้ว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า "อิเล็กตรอน"
การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ ( Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด
ผลการทดลองของออยแกน โกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
สรุปแบบจำลองของทอมสัน
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้
ข้อแตกต่าง
รังสีแคแนล
รังสีแคโทด
1. การเกิด
เกิดจากอะตอมของแก๊ส
เกิดจากอะตอมของโลหะที่ใช้ทำขั้วแคโทดและแก๊ส
2. ชนิดประจุ
ประจุบวก
ประจุลบ
3. การเบี่ยงเบนในสนามแม่เหล็ก
เกิดตรงข้ามกับรังสีแคโทด
เกิดการเบี่ยงเบนออกจากแนวเส้นตรง
4. ทิศทางของรังสี
พุ่งจากขั้วบวก (แอโนด)
พุ่งจากขั้วลบ (แคโนด)
5. ประจุ / มวลเมื่อเปลี่ยนแก็ส
ไม่คงที่
ตงที่เสมอ
6. ชื่อเรียก
รังสีบวก
รังสีลบ
ข้อแตกต่าง
|
รังสีแคแนล
|
รังสีแคโทด
|
1. การเกิด
|
เกิดจากอะตอมของแก๊ส
|
เกิดจากอะตอมของโลหะที่ใช้ทำขั้วแคโทดและแก๊ส
|
2. ชนิดประจุ
|
ประจุบวก
|
ประจุลบ
|
3. การเบี่ยงเบนในสนามแม่เหล็ก
|
เกิดตรงข้ามกับรังสีแคโทด
|
เกิดการเบี่ยงเบนออกจากแนวเส้นตรง
|
4. ทิศทางของรังสี
|
พุ่งจากขั้วบวก (แอโนด)
ไปยังขั้วลบ (แคโทด)
|
พุ่งจากขั้วลบ (แคโนด)
ไปยังขั้วบวก (แอโนด)
|
5. ประจุ / มวลเมื่อเปลี่ยนแก็ส
|
ไม่คงที่
|
ตงที่เสมอ
|
6. ชื่อเรียก
|
รังสีบวก
|
รังสีลบ
|
3.แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ลอร์ดเออร์เนสท์รัทเทอร์ฟอร์ด ( Lord Ernest Rutherford ) นักวิทยาศาสตร์ชาวนิวซีแลนด์ และฮันส์ ไกเกอร์ และมาร์สเคน ได้ทดลองใช้อนุภาคแอลฟายิงไปยังแผ่นโลหะทองคำบางๆ และใช้ฉากเรืองแสงซึ่งฉาบด้วยซิงค์ซัลไฟด์ ( ZnS ) โค้งเป็นวงกลมเป็นฉากรับแอลฟาเพื่อตรวจสอบทิศทางการเคลื่อนที่ของอนุภาคแอลฟา
ผลการทดลอง สรุปได้ดังนี้
ผลการทดลอง สรุปได้ดังนี้
• จุด X เป็นจุดที่อนุภาคแอลฟาผ่านไปยังฉากในแนวเส้นตรง แสดงว่า ภายในอะตอมน่าจะมีพื้นที่ว่างเป็นจำนวนมาก เพราะ อนุภาคแอลฟาส่วนใหญ่ทะลุผ่านแผนทองคำเป็นแนวเส้นตรง
การค้นพบนิวตรอน
สาเหตุที่ค้นพบนิวตรอน
สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
อนุภาคมูลฐานของอะตอม
อนุภาค
ประจุ(หน่วย)
ประจุ(C)
มวล(g)
มวล(amu)
อิเล็กตรอน
-1
1.6 x 10-19
0.000549
9.1096 x 10-28
โปรตรอน
+1
1.6 x 10-19
1.007277
1.6726 x 10-24
นิวตรอน
0
0
1.008665
1.6749 x 10
เลขมวล ( Mass number ) หมายถึง ผลบวกของโปรตอน และนิวตรอนในนิวเคลียส
ไอออน (Ion)
1. ไอออนบวก ( ation ) คือ อนุภาคที่มีโปรตอน มากกว่า อิเล็กตรอน
1. ไอโซโทป ( Isotope )
4.แบบจำลองอะตอมของโบว์
โบร์ได้ศึกษาแบบจำลองอะตอมขึ้นมาโดยนำแบบจำลองอะตอมของรัทฟอร์ดมาแก้ไข เขาศึกษาสเปกตรัมการเปล่งแสงของธาตุ โดยบรรจุแก๊สไฮโดรเจนในหลอดปล่อยประจุ จากนั้นให้พลังงานเข้าไป
สรุปผลการทดลอง
แต่ก่อนที่จะศึกษาสเปกตรัมควรต้องมีความใจเกี่ยวกับคลื่นแม่เหล็กไฟฟ้า
สมบัติของคลื่นแม่เหล็กไฟฟ้า
ความยาวคลื่น ( Wave length ) ใช้สัญลักษณ์ (λ) แลมบ์ดา คือ ระยะที่คลื่นเคลื่อนที่ครบ 1 รอบ ( มีหน่วยเป็น เมตรหรือนาโนเมตร )
เมื่อ E คือ พลังงานของคลื่นมีหน่วยเป็น ( J ) จูล
H คือ ค่าคงตัวของพลังค์ มีค่า = 6.625 x 10 -34 J.s
V คือ ความถี่ของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็น รอบต่อวินาที หรือเฮิร์ตซ์ ( Hz )
เมื่อ c คือ ความเร็วของคลื่นแม่เหล็ไฟฟ้าในสุญญากาศ มีค่า = ความเร็วของคลื่นแสง มีค่า = 3 x 10 8 m/s หรือ เขียนหน่วยเป็น ms-1
สรุปได้ว่า
สเปกตรัม ( Spectrum )
สเปกตรัม มี 2 ชนิด คือ
อนุภาค
|
ประจุ(หน่วย)
|
ประจุ(C)
|
มวล(g)
|
มวล(amu)
|
อิเล็กตรอน
|
-1
|
1.6 x 10-19
|
0.000549
|
9.1096 x 10-28
|
โปรตรอน
|
+1
|
1.6 x 10-19
|
1.007277
|
1.6726 x 10-24
|
นิวตรอน
|
0
|
0
|
1.008665
|
1.6749 x 10
|
เลขมวล ( Mass number ) หมายถึง ผลบวกของโปรตอน และนิวตรอนในนิวเคลียส
เลขอะตอม ( Atpmic number ) หมายถึง จำนวนโปรตอนในนิวเคลียส ซึ่ง = จำนวนอิเล็กตรอนในอะตอม
ไอออน (Ion)
คือ อนุภาคที่มีประจุไฟฟ้า ซึ่งเกิดจากอะตอมเสียหรือได้รับอิเล็กตรอน ประจุไฟฟ้ามี 2 ชนิด ดังนี้
1. ไอออนบวก ( ation ) คือ อนุภาคที่มีโปรตอน มากกว่า อิเล็กตรอน
2. ไอออนลบ ( anion ) คือ อนุภาคที่มีโปรตอน น้อยกว่า อิเล็กตรอน
1. ไอโซโทป ( Isotope )
หมายถึง อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน
2. ไอโซโทน ( Isotone )
หมายถึง อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน
3. ไอโซบาร์ ( Isobar )
หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน แต่มีเลขอะตอมไม่เท่ากัน
4. ไอโซอิเล็กทรอนิกส์ ( Isoelectronic )
หมายถึง อะตอมของธาตุหรือไอออนที่มรจำนวนอิเล็กตรอนเท่ากัน
โบร์ได้ศึกษาแบบจำลองอะตอมขึ้นมาโดยนำแบบจำลองอะตอมของรัทฟอร์ดมาแก้ไข เขาศึกษาสเปกตรัมการเปล่งแสงของธาตุ โดยบรรจุแก๊สไฮโดรเจนในหลอดปล่อยประจุ จากนั้นให้พลังงานเข้าไป
ผลการทดลอง
อิเล็กตรอนเคลื่อนจากขั้วบวกไปขั้วลบชนกับแก๊สไฮโดรเจน จากนั้นเปล่งแสงออกมาผ่านปริซึมทำให้เราเห็นเป็นเส้นสเปกตรัมสีต่าง ๆ ตกบนฉากรับภาพ
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
แต่ก่อนที่จะศึกษาสเปกตรัมควรต้องมีความใจเกี่ยวกับคลื่นแม่เหล็กไฟฟ้า
สมบัติของคลื่นแม่เหล็กไฟฟ้า
ความยาวคลื่น ( Wave length ) ใช้สัญลักษณ์ (λ) แลมบ์ดา คือ ระยะที่คลื่นเคลื่อนที่ครบ 1 รอบ ( มีหน่วยเป็น เมตรหรือนาโนเมตร )
ความถี่คลื่น ใช้สัญลักษณ์ (V) นิว คือ จำนวนรอบของคลื่นที่่ผ่านจุดใดจุหนึ่งในเวลา 1 วินาที ( มีหน่วยเป็นจำนวนรอบต่อวินาที หรือ เฮิรตซ์ (Hz) s-1 )
เมื่อ E คือ พลังงานของคลื่นมีหน่วยเป็น ( J ) จูล
H คือ ค่าคงตัวของพลังค์ มีค่า = 6.625 x 10 -34 J.s
V คือ ความถี่ของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็น รอบต่อวินาที หรือเฮิร์ตซ์ ( Hz )
ในการศึกษาเกี่ยวกับคลื่นทั่วไป พบว่า ความยาวคลื่นจะมีความสัมพันธ์กับความถี่ของคลื่น ดังนี้
เมื่อ c คือ ความเร็วของคลื่นแม่เหล็ไฟฟ้าในสุญญากาศ มีค่า = ความเร็วของคลื่นแสง มีค่า = 3 x 10 8 m/s หรือ เขียนหน่วยเป็น ms-1
สรุปได้ว่า
"คลื่นที่มีความยาวคลื่นมาก จะมีความถี่น้อย และพลังงานคลื่นน้อย"
"คลื่นที่มีความยาวคลื่นน้อย จะมีความถี่มาก และพลังงานคลื่นมาก"
สเปกตรัม ( Spectrum )
หมายถึง แถบสี แถบแสงส หรือเส้นสีของพลังงานในรูปคลื่นแม่เหล็กไฟฟ้า
สเปกตรัม มี 2 ชนิด คือ
1. สเปกตรัมต่อเนื่อง ( Continuousspectrum ) เป็นสเปกตรัมที่ประกอบด้วยแถบของสีที่ต่อเนื่องกันไปจากสีหนึ่งไปยังอีกสีหนึ่ง โดยจะมองไม่เห็นช่องว่างระหว่างสีเลย
2. สเปกตรัมไม่ต่อเนื่อง ( Discontinuous spectrum ) เป็นสเปกตรัมที่มีลักษณะเป็นเส้นสีสว่างบนพื้นสีดำมืดบางที่เรียกว่าเส้นสเปกตรัม โดยมองเห็นเป็นเส้นสีเรียงจากเส้นหนึ่งไปยังอีกเส้นหนึ่ง
สรุปสเปกตรัม
1. สเปคตรัมเป็นสมบัติเฉพาะตัวของธาตุชนิดหนึ่งๆ ซึ่งแตกต่างจากธาตุชนิดอื่น2. สเปคตรัมของโลหะชนิดเดียวกัน มีสี และตำแหน่งของสเปคตรัมเหมือนกัน
สรุปแบบจำลองอะตอมของโบร์
1. อิเลคตรอนจะอยู่กันเป็นชั้น ๆ แต่ละชั้นเรียกว่า “ระดับพลังงาน”
5.แบบจำลองอะตอมแบบกลุ่มหมอก
เนื่องจากแบบจำลองอะตอมของโบร์ใช้อธิบายได้ดีเฉพาะธาตุไฮโรเจนซึ่งมีอิเล็กตรอนเพียงตัวเดียว ดังนั้นถ้าธาตุมีหลายอิเล็กตรอน ทฤษฏีของโบร์ไม่สามารถอธิบายได้ นักวิทยาศาสตร์จึงค้นคว้า ทดลองจนเกิดเป็นแบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งมีลักษณะดังนี้
- อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสด้วยความเร็วสูง วงโคจรไม่จำเป็นต้องเป็นวงกลมเสมอ
- ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้
- บริเวณกลุ่มหมอกหนาทึบ แสดงว่ามีโอกาสพบอิเล็กตรอนบริเวณนั้นมาก และบริเวณที่กลุ่มหมอกจาง แสดงว่ามีโอกาพบอิเล็กตรอนน้อย
เนื่องจากแบบจำลองอะตอมของโบร์ใช้อธิบายได้ดีเฉพาะธาตุไฮโรเจนซึ่งมีอิเล็กตรอนเพียงตัวเดียว ดังนั้นถ้าธาตุมีหลายอิเล็กตรอน ทฤษฏีของโบร์ไม่สามารถอธิบายได้ นักวิทยาศาสตร์จึงค้นคว้า ทดลองจนเกิดเป็นแบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งมีลักษณะดังนี้
- อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสด้วยความเร็วสูง วงโคจรไม่จำเป็นต้องเป็นวงกลมเสมอ
- ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้
- บริเวณกลุ่มหมอกหนาทึบ แสดงว่ามีโอกาสพบอิเล็กตรอนบริเวณนั้นมาก และบริเวณที่กลุ่มหมอกจาง แสดงว่ามีโอกาพบอิเล็กตรอนน้อย
"อะตอมประกอบด้วยกลุ่มหมอกอิเล็กตรอนรอบนิวเคลียส มีลักษณะทรงกลม บรอเวณกลุ่มหมอกทึบแสดงว่ามีโอกาศพบอิเล็กตรอนมาก และบริเวณที่กลุ่มหมอกจางมีโอกาศที่จะพบอิเล็กตรอนน้อย"